
Ⅰ. 肯定的評価
- 2013年:CNNが6歳のシャルロットちゃんのてんかんがCBDオイルで治療されたドキュメンタリーを放映。
- 2017年:WHOがCBDの効果を肯定的に評価する報告書を発表。
- WADA:禁止薬物からCBDを除外。
- FDA:2018年6月、CBDを有効成分とする医薬品EPIDIOLEX(効果、抗てんかん)を承認
- 連邦議会:2018年、THC0.3%以下の農業生産物をHempと位置付けて適法とするFarm Billを可決。
- NIH(アメリカ国立衛生研究所):2019年9月、マイナーなカンナビノイド類(THC以外)とテルペン類疼痛緩和の特性に関する調査に着手したことを発表。
Ⅱ. 否定的評価

【参考】関連するニュースへのリンク[検索ワード: CBD ban ]
http://www.nydailynews.com/news/politics/ny-nyc-cbd-ban-food-drink-cannabis-cannabidiol-20190701-zeujlfjujjdfjp4i5vt46rhnmm-story.html
https://www.washingtonpost.com/business/2019/06/24/cbd-infused-food-beverages-are-still-illegal-under-us-law-so-why-are-they-everywhere/?noredirect=on
https://www.wbur.org/news/2019/06/21/cbd-food-massachusetts-ban-hemp
アメリカの法規制概要
Ⅰ.CSA規制
*麻薬規制の類似の規制。オピオイドも対象
1. 2018年12月のFarm BillによりTHC0.3%以下の大麻製品は、
Marijuanaではなく、Hempとネーミングされ、CSA (Controlled Substance Act)の対象外となった
2. 但し、これはTHC 0.3%以下なら麻薬規制からはずれるということで、その次のハードルとしてFDA規制がある
Ⅱ.FDA規制
1. 3段階規制
1)治療的効果をうたうものは違法(薬事法違反)
2)サプリメント形態は違法(薬事法違反)なぜならサプリメントとしての安全性に疑問がある
(やるなら医薬品でやるべき)*
【参考】
https://www.mdpi.com/1420-3049/24/9/1694/htm
①農業や重金属などの汚染問題
②肝機能障害、医薬品との相互作用、眠気、下痢、ふさぎ込み
③動物試験の結果によると、男性のテストステロンレベルを下げ性的機能を害する
④子供や妊婦や授乳時の女性の累積的使用に対しても疑問がある
⇩
2019.11.25でさらに強調
*2018年6月、CBDを有効成分とするEpidiolexを抗てんかん医薬品として承認
➡①承認手続きを要求すれば安全性は確認できる
➡②マーケットに出てもドクターがコントロールできる
3)一般食品形態
*新成分に関し、GRAS(Generally Recognized As Safe)という
手続きがある
ⅰ.次の3タイプはGRASの手続きでOKとなった(2018年12月)
①hulled hemp seed(皮つき種)
②hemp seed protein powder(種由来パウダー)
③hemp seed oil(種由来オイル)
ⅱ.それ以外はペンディング状態
4)結局、3)の①②③のみCBD+THC<0.3ならCSA規制もFDA規制も
クリアー
Ⅲ.州の規制
1.FDA規制がカバーするのはInterstate(州間取引)
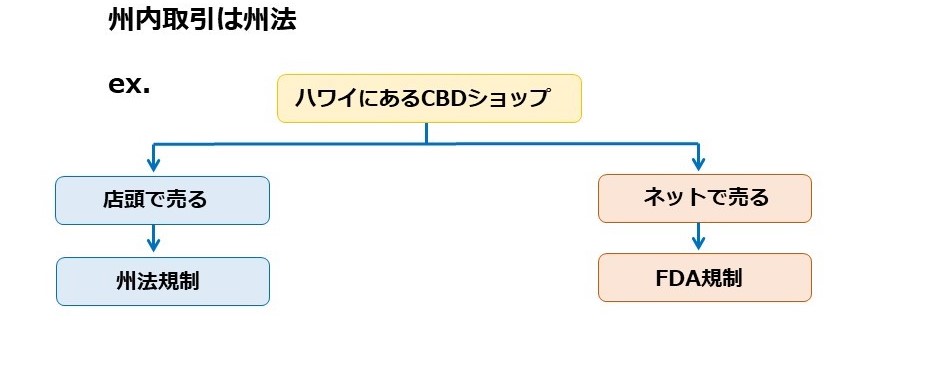
2.NY州
Foods&DrinksへのCBDの使用禁止

Ⅳ.TOPICAL SOLUTION
以上は服用型
化粧品型のTOPICAL SOLUTIONは治療効果をうたわない限り、FDAも不可としない
➡ 但し、2019.11.25は服用との併用を懸念
Ⅴ.まとめ
この1年の動きを注意深くWatchする必要あり
アメリカのCBD法規制– 最新情報〈2020/2/28現在〉
- FDA(米食品医薬品局)
厳しいスタンスであることは概要に記載した通り。 - USDA(米農業省)
農産物を出荷する前に、THCが0.3%未満であるかを検査するフローを検討中 - ProCBDの巻き返し
薬事法改正 ⇒ CBDがサプリメントに該当することを明確にする(修正法案HR5587)【法案抜粋】
If passed in its current form, HR 5587 would amend the FDCA’s definition of dietary supplement (21 U.S.C. 321(ff)(3)(B)) as shown below in bold:
The term “dietary supplement” does not include—
(i) an article (other than hemp-derived cannabidiol or a hemp-derived cannabidiol containing substance) that is approved as a new drug under section 355 of this title, certified as an antibiotic under section 357 of this title, or licensed as a biologic under section 262 of title 42, or
(ii) an article (other than hemp-derived cannabidiol or a hemp-derived cannabidiol containing substance) authorized for investigation as a new drug, antibiotic, or biological for which substantial clinical investigations have been instituted and for which the existence of such investigations has been made public… - 州
1)NY州 ⇒ 一般食品への制限は概要に記載した通り
2)カリフォルニア州 ⇒ NY州に従う動きもあったが、連邦の動向待ちとなった。
アメリカのCBD法規制 – 最新情報〈2020/4/6現在〉
今年1月23日付で超党派議員により米下院議会委員会に提出された連邦法修正法案HR5587(前回「アメリカの法規制〈2020/2/28現在〉」をご参照)は、その後、追加審議や承認手続きが行われることもないまま、現在も塩漬け状態にある。
しかし、現FDA長官のStephen Hahn医学博士は、2月下旬にワシントンDCで開催された米農務省協会の冬季政策会議において、「現状、米国内で販売される一部CBD製品に安全性データの不備と健康被害の懸念はあるものの、すでに一定規模の国内市場が形成されており、これをいまから全面的にクローズしていくことは難しい」とのコメントを新たに発表した。
また同長官は、「CBDの効果や安全性に関する正しい情報を消費者に提供することで既存の情報ギャップを埋め、消費者自身が商品選択の正しい判断を行えるようにしたい」との意欲を改めて示した。つまり、「CBDマーケットをクローズさせたいわけではわけではないが、依然、解決すべき問題は残されている」という含みを持たせた発言に、今後の動向が注目される。
アメリカのCBD法規制 – 最新情報〈2020/5/15現在〉
- FDA長官自らCBD関連法案の早期成立に前向きな態度を示した今年2月以降、全米に急速に拡大した新型コロナ危機への対応を急務とする連邦議会において、その法案審議に大幅な遅れが発生している。
- この状況は、現場の防疫対応に専念したい全米各州でも同様である。
例えばカリフォルニア州をみても、この3月中旬から5月上旬までの間、州議会自体の開催が見送られてきた状況にあり、通常この時期に審議されるはずである10~15件の法案から、CBD法案を除く優先順位の高い5~6件程度しか処理できないだろうとの見方もある。
これにより、本年度の州政府予算成立にも大幅な遅れが発生しており、大麻業界に直接関連する予算審議と承認が、恐らく今年の8月以降に持ち越されるとの見通しが有力だ。 - また今回の新型コロナ禍は、大麻製品を扱う業界全体の販売実績にも暗い影を落とし始めており、同州サンディエゴに拠点を持つCBD製造業者の場合は、2020年第1四半期の収益が対前年度比で45%も下回ったことがわかった。
よって、CBD関連法案成立の遅れによる市場全体の停滞に加え、新型コロナ禍による需給の混乱と販売実績の低迷が、この先市場の成長にさらなる負の影響を与えることが強く懸念される。
アメリカのCBD法規制 – 最新情報〈2020/7/22現在〉
- CBD製品の安全性(肝毒性)試験に関し、そのプロトコル開発に携わってきたValidCare社は、いよいよ今年7月より同試験に着手することを発表した。
試験は、CBD製品トップブランド数社による10万ドル規模の支援を受けようやく実現したものだが、現状、新型コロナ問題でCBD規制法案成立への対応が遅れる米国食品医薬品局(FDA)にとって極めて重要な安全性データが提供されることになり、同法案成立に向けてさらに大きな弾みになると見られている。 - 同安全性試験は7月~9月の2ヶ月間、計1000人の被験者を対象に実施される。
被験者は試験実施60日前からCBDの経口摂取をはじめ、開始後30日間で健康被害の有無等を日誌に記録する方式。
また、被験者からは血液サンプルも採取され、4種の肝機能に関する基礎データも取得・分析される。
なお、この試験は、先行するてんかん治療薬「Epidiolex」の治験において、高用量700mgを越えるCBD摂取が特定の肝臓酵素レベルを上昇させる傾向があることを念頭に計画されたが、今回はCBD含有サプリの現実的な用量に近いレベルでの有害事象検出を目的とするため、ValidCare社から結果データが共有されるFDAは、今後同データが一般的なCBD食品メーカーや小売店にも幅広く活用されることを期待している。 - 一方、カリフォルニア州とフロリダ州の連邦地裁は、CBD製品やその広告上の表示に虚偽があったとして、2019年以降に消費者団体等から集団訴訟(クラスアクション)を提起されていた4~5件の事案に対し、「第一次管轄権」を持つFDAがCBD規制に関する新ガイダンスを公開するまでは、裁判所内の審理を停止する方針を明らかにした。
これを受けて、Global Widget Hemp Bomb社を相手に集団訴訟を起こしていた原告Kenneth Glass氏(カリフォルニア州地裁)も、同訴訟を一旦取り下げ、FDA側の進捗が見られるまでこれを保留する意向を示した。
このような動きに対して有力な業界団体The Center of Responsible Nutritionの代表は、現時点でもCBD含有食品が数多くリリースされ続けている現状を憂慮し、今後FDAがCBDの安全性データを健食サプリのみならず、一般食品の評価にも早期に適用できる状況にするよう強く促した。
アメリカのCBD法規制 – 最新情報〈2020/11/12現在〉
米ニューヨーク州健康局は10月26日、かねてより市場関係者から期待されていたCBD製品の製造と販売に関する新しい規制方針を公開し、その内容について11月10日から翌2021年1月11日までの間、パブリックコメントを広く募集すると発表した。
その中で、今回注目すべき点は以下の通りである。
◎NY州によるCBD規制方針の概要[一部抜粋]
(昨年発表したNY州の方針とは異なり)食品や飲料へのCBD添加や販売は問題ないとするが、アルコールやタバコ製品にはこれを認めない。また、注射、インヘーラー(吸引器)、スキンパッチなどを使用して摂取する製品も不可。
CBDベープ製品(器具により熱蒸発させたリキッド成分を吸引するもの)は問題ないが、大麻の「花穂部分」をタバコに混ぜて販売するのは不可。
精神作用を及ぼす大麻の規制成分THC 0.3%以上を含有するCBD製品は、消費者向けに一切販売できない。ただし、NY州内における中間製造業者間の取引に関しては、最大3%までのTHC含有量を認める。
食品や飲料にCBDを添加する場合、1食あたりのCBD添加量は25㎎までとし、オイルやチンキ剤などの場合には、1製品あたり3,000㎎までを限度とする。
CBDやその他大麻成分を含有する食品や飲料製品のパッケージングは「製造者」が行うものとし、小売レベルで同様の成分が任意に追加されてはならない。(例、店舗で調理販売するクッキーにCBDを混入するなど)
CBD含有製品が特定の疾病治療に効果があるかのような表示や広告はできない。また、それらが未成年者を勧誘するような見せ方も不可。
CBD製品のパッケージ上、その製品が製造された州名あるいは国名をかならず明記する。
CBD製品を含む大麻製品を販売するすべての小売業者(店販・通販を含む)は年間300ドルのライセンス料を州に収めること。(他方、製造業者は、初回登録から最初の2年間で2,500~5,000ドルの登録料を収めるものとする。)
今回公開された新しい方針で特筆すべき点は、①「昨年夏にNY州が宣言し、先行する業界に一石を投じることとなった『食品・飲料へのCBD添加禁止』の原則が大幅に緩和されたこと」であり、さらに②「連邦麻薬取締局(DEA)が製造業者に一律課すとしていた製品中THC含有量0.3%の縛りが、同州内の中間業者間の取引においては『3%まで緩和』された」と言うことだろう。
これについて、同州で有力な大麻製造業者団体NYCGPAはプレスリリースを発表し、「(新法は)米国内で最も厳格なルールのひとつであることに変わりないが、サプライチェーンの透明化や適正な品質の規格化によりCBD市場の底上げに貢献するものだ」とし、また、「業界の特殊性やその複雑さにも関わらずバランス良く考慮されており、将来的な『GMP(適正製造規範)規格化』への布石ともなる貴重な一歩だ」として前向きに評価している。
いずれにせよ、今後の連邦各法制定にも大きな影響力を持つNY州の法案が、これから始まるパブコメによる「洗礼」の過程を経て、どのように形づくられていくものか、州や連邦の内外から強い関心を寄せられていることは間違いない。
アメリカのCBD法規制 – 最新情報〈2020/12/25現在〉
FTCもついに着手! CBD製品の違法広告に初の制裁金支払い命令
米国の公正取引委員会にあたる連邦取引委員会(FTC)は12月17日、市場に流通する一部CBD製品の広告が、消費者を誤認させるヘルスクレームを掲載していたとして、製造販売業者計6社に対し制裁金の支払いを命じた。同委員会として違法業者に制裁金を課すのは今回がはじめてのケースとなる。
この消費者保護を主たる目的とする独立行政機関のFTCは、同製販業者らが、がん、高血圧、アルツハイマー症候群の治療や症状の緩和に有効であるかのような広告訴求を行っていたとしている。これについて、FTCの消費者保護局アンドリュー・スミス局長は、「今回の処分はCBD製品自体の効果や有効性を否定するものではないが、ヘルスプロダクトとして全ての製品に適用される基本的なルールであり、科学的な見地から虚偽や誇張は決して許されるべきではない。」とのコメントを発表した。
以下は、今回処分の対象となった業者と処分の一覧。
Bionatrol Health and Isle Revive社 [ユタ州]: $20,000
Epichouse (First Class Herbalist)社 [ユタ州]: $30,000
CBD Meds Inc.社 [カリフォルニア州]: 広告の出稿差止め処分のみ
Easybutter and HempmeCBD社[フロリダ州]: $36,254
Reef Industries and CannaTera社 [カリフォルニア州]: $85,000
Steves Distributing社 [コロラド州]: $75,000
なお、今回の処分にあたり、FTCはいくつかの具体的な表現事例を公表した。それによると、「CBDが痛みを緩和し、何歳も若々しく感じる」と訴求した例や、ユーザーボイスを使って「処方薬のオキシコンチンをCBD製品に置き換えることで慢性病が治癒した」と訴求した例もあったとしている。
これら処分対象となった業者には、「全購入者へ45日以内に通知を行うこと」と、「実行済みアクションに関するリポートをFTC宛て90日以内に提出すること」を義務づけている。
また、制裁金の支払い命令は、FTCとして今回が最初の発動事例となったが(広告差し止め処分としては、4月に「抗ウイルス」を謳った業者に対して適用した実績あり)、今後同様の「根拠なきヘルスクレーム」が市場に散見される場合には、さらに多くの処分が行われるであろうことを改めて予告している。
FDAはCBD製品の点眼や吸入式用法に警鐘!?
一方、米食品医薬局(FDA)は12月22日、一部のCBD製品が「インヘーラーなどでの吸入」や「目薬式の点眼」を用法としていることに「公衆衛生上の懸念」があるとし、これら製品を製造販売する業者計5社に対し警告状を送付したことを発表した。
個別の警告内容については以下の通り。
- Bee Delightful社 [テキサス州]
→同社製品が、「多発性硬化症および関節リウマチの痛み緩和」や、コロナ禍に乗じて「免疫機能の強化」に効果的であるなどと謳ったことが問題とされた。 - G&L Wellness社 [ウイスコンシン州]
→ヒト用およびペット用の点眼薬をそれぞれ発売する同社が、いずれも「ヒトとペットのための多症状向けアイケア・ソリューション」と謳ったことが問題とされた。 - New Leaf Pharmaceuticals社 [コネティカット州]
→同社の販売する鼻腔スプレー製品の「血流への急速な吸収特性」に、公衆衛生上の懸念があると見なされた。同社は、2019年にも製品が「動脈閉塞に有効」とのネット投稿を行ったり、FAQ上で「がんや腫瘍と闘う」などの掲載をしていた。 - NextL3vel Services Group社[ネバダ州]
→ペット用シャンプーやおやつ、ヒト用オイルや点眼薬などを販売する同社は、「小児の注意欠如(ADD)や多動性障害(ADHD)」のソリューションとして、「子供のイラスト付き広告」を行ったことが特に重大であると問題視された。 - Wellness Biosciences Rx社[テキサス州]
→同社の販売するインヘーラー(口腔吸入器)型製品に含まれる成分が、「咽頭けいれんや気管支けいれんを引き起こし、ヒトの上気道および下気道組織に有害となる潜在的可能性がある」と見なされた。また、同社がツイッター上に「吸入されるCBDが禁煙に役立つ」と複数回投稿したことについても大いに問題視された。
今回出された警告に制裁金の処分は含まれないが、対象業者には「FDAに対し15営業日以内に是正措置の報告を行うこと」が義務付けられた。
FDAは現在のところ、まだ「医療向け販売チャネルを介する場合」にのみCBD製品の販売を許可している段階にあるが、新しいCBD法案の策定に向けたタスクフォースを率いるエイミー・アバネシ―博士は、「FDAのポリシーがいずれ変更されるまでは、引き続きCBD製品の『OTC的使用法』に対する警告を発し続けることになる」との基本方針を明らかにした。
なお、これに先立つ今年7月、FDAは米大統領府に対し、「CBD新法案の業界向け施行方針」を提出済みだが、現時点でホワイトハウスからはまだ承認が出ていない状況にある。
アメリカのCBD法規制 – 最新情報〈2021/2/18現在〉
FDAによるCBD法案撤回に健食業界が反発
FDAは1月21日、昨年7月に同局が米大統領府宛て上程していたCBD規制法案が、前日に発足したバイデン新政権からの指示に基づき撤回されたことを発表した。なお、今回の政権交代劇やいまだ収束には程遠いコロナ禍の影響もあり、ある程度承認の遅れは予想されていたが、この期に及んで保留中の法案そのものが白紙撤回されるに至り、米国内の健食業界関係者や関連団体の失望は甚だ大きい。
FDAは、市販用CBD製品の急速な市場拡大に法整備が追いついていないことを認めた上で、1年以上もの時間をかけて新法案を準備し、ようやく昨年7月に大統領府へ決済を委ねるに至った。これを受け、前トランプ政権は、GW Pharmaceutical社や小売チェーンGeneral Nutrition Center (GNC)社など有力企業を含むCBD製品の製造および販売業者と、規制ガイドラインの在り様について議論を重ねてきたとされる。しかしながら、新政権によって前政権の積み残し施策が一様に「廃棄処分」されるに至り、まさに新政権側の政治的思惑で泥をかぶる形になったとも言える。
また、FDAのスポークスマンによると、同局は今後もCBD新法を重要なパブリックヘルス関連事案と位置づけ、引き続き新政権と緊密な連携を取っていくとしているが、大統領府へ法案を再上程するタイミングなどついては、いまだ具体的明言を避けている。
アメリカのCBD法規制 – 最新情報〈2021/3/15現在〉
前トランプ政権から半年間以上も保留とされてきたCBD規制新法案が、バイデン政権発足の翌日にあたる1月21日、新政権側からの指示により急遽白紙撤回されるに至ったことは、関連する業界関係者の大きな失望と落胆を呼んだ。
あいにく、ただでさえワクチンや治療薬の承認などCOVID-19対策を優先せざるを得ないFDAとしては、新政権に対する同法案の再上程すら実現しない足踏み状態にあるが、CBD市場の急速な成長に法規制が追い付かないことは、結果的に業界のみならず消費者側の著しい不利益となり兼ねないことから、新法案の成立に向けて一日も早い事態の進展を望む声は大きい。
アメリカのCBD法規制 – 最新情報〈2021/4/27現在〉
バイデン新政権の発足に伴い、前政権から保留となっていた「CBD法案」が撤回されたことは前号でもお知らせした通りだが、さらにその先行きに一抹の不安を感じさせる動きがあった。
3月31日付で「健康産業速報」(インフォーマー マーケッツ ジャパン㈱刊)が伝えた内容によると、アメリカの消費者団体「公共の利益のための科学センター」、「消費者レポート」、「アメリカ消費者連盟」、「全国消費者連盟」およびハーバード大学のピーター・コーエン氏らは、「ヘンプおよびCBD消費者保護および市場安定化法案」(いわゆるCBD法案)に反対を表明する書簡を全米の各上院議員宛て送付したという。
同法案は、前述のバイデン政権による前案撤回後、2月4日付で超党派議員によって議会に提出されたものだが、その主旨としてはCBDを新規食品成分(NDI)として申請することを条件に、同含有製品をサプリメントとして法的に位置づけ、一般的なサプリと同様のGMPや表示および販売規制を適用することを目指している。
書簡の中でコーエン氏は、「この法案が成立すれば、FDAの現在の消費者の安全を守る取り組みがないがしろにされ、安全でないCBD市場が形成される。何百もの危険な化合物を含んだ製品が出回る」としているが、これに対し、ヘンプ業界団体のジョナサン・ミラー弁護士は、「主張は正反対。規制がないため市場に安全でない製品が出回る。CBD製品の製造を規制するCBD法を切実に必要としている」と業界誌Nutrition Product Insiderに答えたとされる。
なお、このような動きの中にあって、米FDAは3月、CBD含有製品の広告上で「がん細胞の成長抑制」や「新型コロナの治療効果」を標榜していたCannafyl社、さらに「痛み止め効果」を標榜していたHonest Globe社とBiolyte Laboratories社らに対し、「連邦食品・医薬品・化粧品法(FDC法)に基づく警告文書*の送付を行っている。
